赖氨酸的脂酰化(lysine fatty acylation)修饰在哺乳动物细胞内已被发现30多年。近年来,该修饰在调节Ras家族小G蛋白(small GTPases)的胞内定位及活性的功能也引起了人们的广泛关注。尽管哺乳动物细胞内去掉这种修饰的酶——Sirtuin家族蛋白——已经被报道,催化这种修饰形成的酶却至今尚未被找到。近日,康奈尔大学的林合宁教授团队发现NMT1和NMT2能够催化ARF6蛋白上赖氨酸的豆蔻酰化(lysine myristoylation),并阐明了该修饰调控的ARF6独特的膜定位机制。
在该研究中,作者首先利用多种方法分别在体外和细胞内鉴定了ARF6第3位的赖氨酸能够在NMT1或NMT2的催化下被豆蔻酰化,且该豆蔻酰化影响着ARF6在细胞内的定位。同时,他们还发现Sirt2可以去掉这个修饰。有意思的是,他们发现NMT更倾向于识别结合有GTP的ARF6而Sirt2更倾向于识别结合有GDP的ARF6。ARF6作为小G蛋白,当结合了GTP时即成为活化状态,这时可作用于下游分子进行信号转导,而当GTP水解成为GDP时(自身为GTP酶)则回复到非活化状态。因此,作者猜想ARF6蛋白K3的豆蔻酰化很可能调控着ARF6在活化状态与非活化状态之间,以及不同胞内膜结构之间的转运,进而影响ARF6的功能。进一步的生化实验证明了这种猜想,他们发现K3的豆蔻酰化和去豆蔻酰化调节着ARF6的活性,进而影响了ERK蛋白的磷酸化。
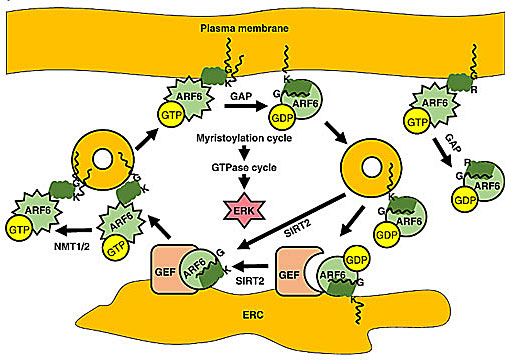
这种将蛋白质的赖氨酸脂酰化与去脂酰化循环,同小G蛋白的活化与去活化循环耦合起来的机制,使得细胞能够以更高的时间和空间分辨率去调控细胞信号转导。文中还提供证据表明,这种赖氨酸的脂酰化修饰以及调控机制很可能适用于更多的蛋白。另外,鉴于ARF6-ERK信号通路在多种生命活动中的重要性,该机制也提供了潜在的疾病治疗的靶点。
这一成果近期发表在Nature Communications 上。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

NMT1 and NMT2 are lysine myristoyltransferases regulating the ARF6 GTPase cycle
Ian R Price, Caroline J DeHart, Xiaoyu Zhang, Paul M Thomas, Chengliang Zhu, Neil L Kelleher, Kayla N Johnson, J Christopher Fromme, Shuai Zhang, Hening Lin, Steve L Halaby, Garrison P Komaniecki, Tatsiana Kosciuk, Min Yang
Nat. Commun., 2020, DOI: 10.1038/s41467-020-14893-x
 0
0












