N-杂芳烃广泛存在于天然产物和活性药物分子中,Minisci反应为杂环C-H键烷基化提供了一种快速、直接的方法,这种N-杂芳烃的直接官能团化简化了杂环的多样性合成,因而备受化学家的关注。Minisci研究团队用银氧化剂在高温下从相应的羧酸制得烷基和酰基自由基(图1a),在对杂芳烃进行自由基加成时,加入化学计量的过硫酸盐确保自由基中间体I的芳香性驱动氧化,生成最终产物II。光氧化还原催化和电化学最近也被用于自由基的生成,使得自由基前体更加广泛,且通常能在更温和的条件下反应。这些方法促进了将结构不同的基团引入到复杂的杂芳烃中,并且已经被药物化学家快速地用于药物相关化合物的后期多样性衍生化。然而,传统和现代的Minisci反应都有局限性。特别是需要氧化剂来促进中间体I的重新芳构化并推动整个反应。因此,经典Minisci反应的高氧化性条件可能会限制官能团容忍性及其在复杂分子中的应用。

图1. 经典的Minisci酰化反应及本文的工作。图片来源:Angew. Chem. Int. Ed.
近日,西班牙加泰罗尼亚化学研究所(ICIQ)的Paolo Melchiorre教授(点击查看介绍)课题组报道了可见光促进的喹啉和异喹啉的自由基C-H键官能团化,在不使用外部氧化剂的情况下产生酰基自由基,使得非传统的Minisci反应成为可能(图1b)。这项研究基于作者最近的发现,4-酰基-1,4-二氢吡啶(acyl-DHPs,1)在吸收可见光时可以产生丰富的光化学。且激发态的acyl-DHPs 1*可以作为强的单电子转移(SET)还原剂,同时可以产生亲核性酰基自由基。该反应生成羟烷基化产物III,而不是经典的Minisci型酰化产物II。相关工作发表在Angew. Chem. Int. Ed. 上。
作者用苯甲酰衍生物1a(可以在可见光区域吸收光)和异喹啉2a作为模板底物,在CH3CN中使用蓝光(HP)LED (λmax = 460 nm,辐照度为30 mWcm-2)进行反应(图2)。当使用TFA(2当量)活化2a时,得到单一的羟烷基化产物3a,产率为72%。没有光照时该反应未发生。当反应在没有酸的情况下进行时,生成复杂的混合物以及12%的3a。此外,该反应还可以耐受痕量的水,并且在溶剂不除氧的情况下也能有效地进行反应。同时该反应能够以1.5 mmol的规模进行,且产率也不受影响。
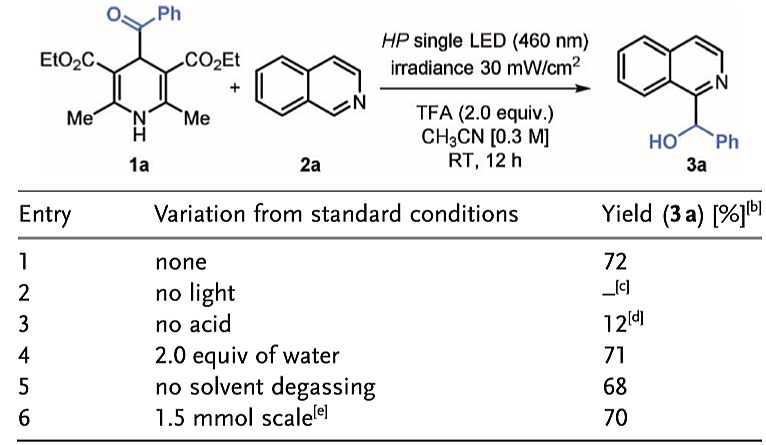
图2. 反应条件优化。图片来源:Angew. Chem. Int. Ed.
有了最佳反应条件,作者接着评估了这种光化学策略的合成潜力(图3)。得到的羟烷基化N-杂芳烃产物3是重要的骨架,这用其他合成方法均难以获得。该方法使用简单易得的底物(acyl-DHPS 1可一步合成),并且各种苯并氮杂环类化合物反应良好,异喹啉和喹啉类底物都可发生羟烷基化反应(图3a)。对于后者,取代基的存在将选择性官能团化在C2或C4位,而未取代的喹啉底物则得到1:1的区域异构混合物。该反应具有显著的官能团耐受性,特别是对容易氧化的基团如伯胺(-NH2,3c)、醇(-OH,3f)、苯酚(3d)和二芳胺(3k)。
为了证明该反应在药物化学中的潜在效用,作者制备了强效PKA抑制剂H-89和抗疟疾药的中间体,它们分别顺利地进行了羟烷基化反应得到3c和4-羟基喹啉-β-葡萄糖苷衍生物3j。作者还分别对奎宁(3i)、抗癌药物bosutinib(3k)和喜树碱(3o)进行了考察。该方法还可以一步得到嘌呤受体拮抗剂4-喹啉甲醇衍生物(3l)。然而,吡啶类底物反应性较差,例如2-氯-4-(三氟甲基)吡啶反应后得到复杂的混合物,并且原料回收80%。
为了考察acyl-DHP 1自由基前体的适用范围,作者选择了一种功能化中间体用于合成缺氧诱导因子脯氨酰羟化酶抑制剂roxadustat(图3b)。对于1中的芳香基团,无论其电性和空间位阻如何,不同的取代基都能很好地耐受,以良好的产率获得了相应的羟烷基化产物,例如:萘基(3q)、酰胺基(3u)、烷基取代基(3v)以及环丙基(3w)。

图3. 底物扩展。图片来源:Angew. Chem. Int. Ed.
然后,作者通过实验和理论计算对反应机理进行了研究。首先,作者研究了Minisci型产物酮4a是否是反应的中间产物(图4a)。当单独制备的样品4a在无光条件下反应时完全没有形成还原产物3a,而在蓝光辐照下则观察到约14%的3a。这些实验结果排除了acyl-DHP 1a作为还原剂的可能性,并表明在该光化学条件下不会形成Minisci酰化产物4a。图4c描述了整个反应过程的机理。首先,可见光激发使1a变成强还原剂1a*,质子化6,7-二甲氧基异喹啉2b的氧化还原电位明显降低,表明从1a*到2b-H+的SET在热力学上是不可行的。电化学测量还显示由1a光解而产生的吡啶鎓离子(Pyr-H+)具有合适的氧化还原性质,从而可以接受1a*的电子。这个SET过程触发了不稳定的acyl-DHP自由基阳离子IV的形成,随后IV分解产生酰基自由基V。V与质子化杂芳烃2a-H+发生加成反应,得到自由基中间体VI,去质子得到I型α-氨基自由基。I中的羰基被酸活化后触发了氮杂环的重新芳构化,产生自由基VII,这一步类似于自旋中心位移(SCS),密度泛函理论(DFT)进一步证实了该过程,即I中羰基的质子化引起电子自旋密度转移到相邻的苄基碳上(图4e)。随后,VII与PyrH▪发生SET还原生成碳负离子VIII,接着质子化形成产物3a,氘代实验进一步证实了该过程,85% D在3a的α-OH位置(图4d)。

图4. 机理研究。图片来源:Angew. Chem. Int. Ed.
自由基介导的自旋中心位移(SCS)在生物化学和合成领域中都具有很重要的作用(图5a、5b)。从机理上讲,它通常与自由基中心相邻原子上离去基团(通常是水)的消除有关,该工作中,作者进一步扩展了SCS的范围,即羰基(通常是π电子)也可以作为离去基团(图5 c)。

图5. 自旋中心位移(SCS)过程。图片来源:Angew. Chem. Int. Ed.
总结
Paolo Melchiorre教授课题组开发了一种光化学方法,实现喹啉和异喹啉的直接羟烷基化。这种方法不同于经典的Minisci反应,实现了其他方法很难达到的转化。该方法通过自由基生成策略避免使用外部氧化剂,反应条件温和,官能团兼容性良好,可用于氮杂环的多样性合成。该反应的关键在于SCS进程,其中羰基π电子的作用类似于离去基团。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photochemical C-H Hydroxyalkylation of Quinolines and Isoquinolines
Bartosz Bieszczad, Luca Alessandro Perego, Paolo Melchiorre
Angew. Chem. Int. Ed., 2019, 58, 16878-16883, DOI: 10.1002/anie.201910641
导师介绍
Paolo Melchiorre
https://www.x-mol.com/university/faculty/41610
 0
0












