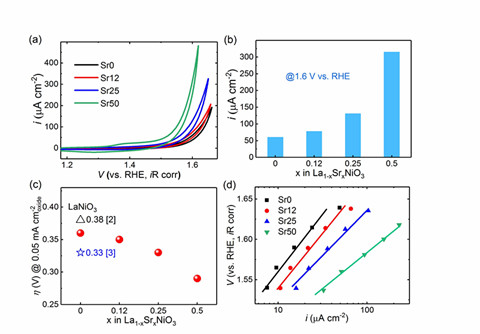
亚甲基环丙烷(Methylene CycloPropane, MCP)是一类具有高张力、高反应活性且易于合成的化合物,在路易酸或过渡金属作用下具有多种独特的断裂/重排模式,因而备受有机合成化学家的关注。其中MCP与烯烃的[3+2]环化反应尤其引人瞩目,因为它是合成具有环外双键的环戊烷的最有效方法之一。早期P. Binger教授等研究人员报道了多个催化体系,这些体系一般涉及零价金属钯或镍对MCP的氧化加成机理(图1a),导致反应条件较为苛刻或烯烃底物范围较为狭窄(缺电子烯烃或乙烯)等问题。
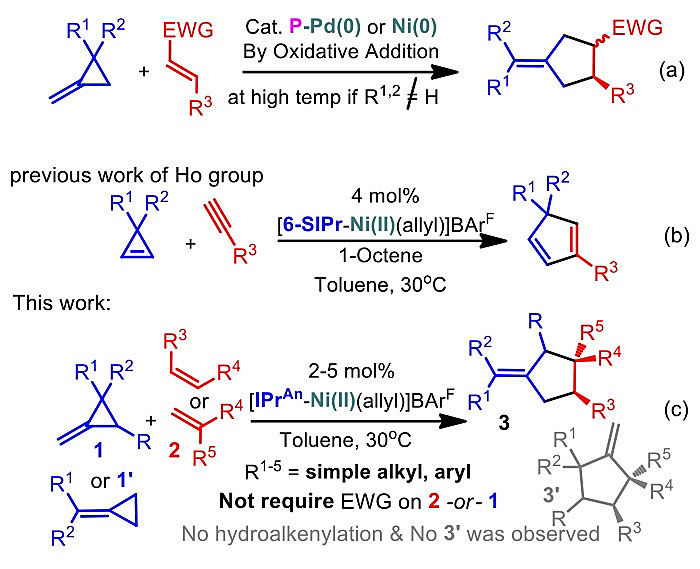
图1. 来自Angew. Chem. Int. Ed.
最近,南方科技大学何振宇(点击查看介绍)课题组报道了一种NHC/Ni(II)催化的MCP与烯烃的[3+2]环化反应(图1c)。该二价体系有别于以往零价体系,反应只需要在常温、中性条件下进行,而且首次拓展了新的MCP与烯烃底物应用范围,可以高效转化为具环外双键环戊烷化合物并取得良好到优秀的收率(图4,例如包括了富电子烯烃在内的多种类型烯烃、杂原子(O\N\Si\B)取代、大位阻烷基(Cy\tBu)取代的多种未活化烯烃、降冰片烯类化合物、环已二烯、环戊烯、二氢呋喃等都能与MCP反应)。此外,该二价体系还具有汇聚合成特色,首次将两种MCP同分异构体(图1c , 2a, 1 & 1')与简单烯烃进行分子间的汇聚合成,获得了同一结构的具有环外双键的环戊烷产物(图2a),绕过了一般零价金属体系与远端和近端选择性开环相关的挑战和限制。

图2. 来自Angew. Chem. Int. Ed.
值得一提的是,上述MCP与烯烃的[3+2]环化反应并不是(NHC)Ni(II)物种原位还原为(NHC)Ni(0)后催化的。控制和条件优化实验都表明直接使用(NHC)Ni(0)物种并不能进行同样的反应(图3),这与P. Binger教授等研究人员报道的氧化加成机理大相径庭。尽管完整的反应机理尚待证实,作者基于零价镍控制实验、汇聚合成结果、当量催化剂控制实验结果(见SI)并检视了文献中MCP在高热下重排的可能性后,提出了NHC二价镍在室温下诱导MCP重排的反应机理。首先,NHC二价镍可能诱导MCP进行重排反应,得到关键的烯丙基两性离子中间体(Allyl Zwitterion),随后与氢烯基化反应类似,进行烯烃插入并关环得到五元碳环产物(图2d)。MCP同分异构体(1 & 1')可能在重排时汇聚成了同一的烯丙基两性离子中间体,因此得到了相同的产物。优化NHC配体可以提高选择性和产率,本反应的配体设计与他们之前发表的环丙烯-未活化炔烃进行交叉氢烯基化重排反应(hydroalkenylation/rearrangement cascade,HARC, Angew. Chem. Int. Ed., 2019, 58, 5702)的需求并不相同(图1b)。
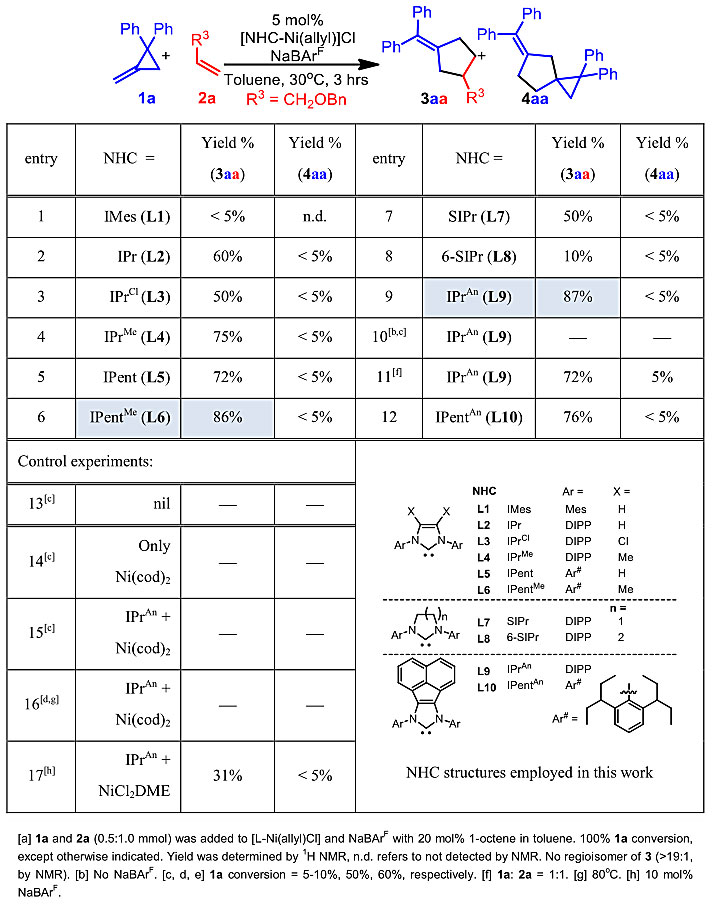
图3. 来自Angew. Chem. Int. Ed.
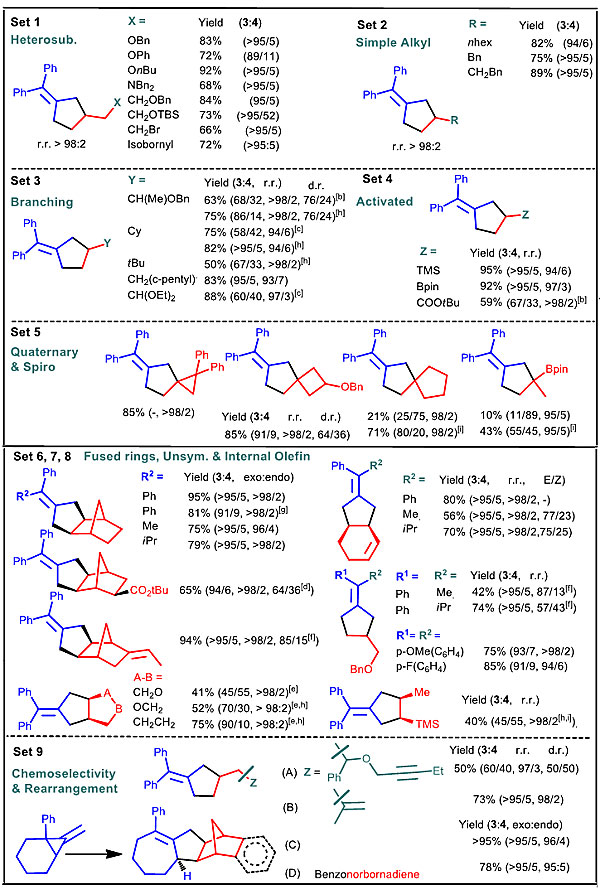
图4. 来自Angew. Chem. Int. Ed.
综上,何振宇课题组在实现了环丙烯与未活化炔烃的环化反应后,进一步发展了MCP与未活化烯烃的[3+2]环化反应,反应条件温和,底物范围广,同时反应产物可方便得转化为环戊酮(图2c),目前相关的不对称研究工作正在进行中。上述研究结果近期发表于Angewandte Chemie-International Edition ,第一作者为南方科技大学的博士后黄建强。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

NHC/Nickel(II)-Catalyzed [3+2] Cross-Dimerization of Unactivated Olefins and Methylenecyclopropanes
Jian-Qiang Huang, Chun-Yu Ho
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.201914542
导师介绍
何振宇
https://www.x-mol.com/university/faculty/45853
参考文献:
1. [(NHC)(NiH)-H-II]-Catalyzed Cross-Hydroalkenylation of Cyclopropenes with Alkynes: Cyclopentadiene Synthesis by [(NHC)Ni-II]-Assisted C-C Rearrangement
Jian-Qiang Huang, Chun-Yu Ho
Angew. Chem. Int. Ed., 2019, 58, 5702-5706, DOI: 10.1002/anie.201901255
 0
0